حلول أسئلة الصف السادس الإعدادي
حل اسئلة رياضيات - علوم - عربي وجميع الكتب والمواد الأخرى
الدرس 3-8 المحاليل المنظمة (محاليل بفر)
يتطلب الكثير من العمليات الصناعية والحيوية أن لا تتغير قيمة pH لوسط التفاعل كثيراً، بل تبقى قريبة من قيمة معينة ومثال ذلك أن الدم في جسم الإنسان لا يمكن أن يقوم بوظيفة نقل الأوكسجين إلى الخلايا إلاّ أن تكون قيمة pH=7.4 وكذلك أن الأنزيمات تحتاج لوسط تكون فيه قيمة pH ثابتة تقريباً لتعمل بنشاط وغير ذلك من العمليات الكيميائية، و تبدي الكثير من المحاليل سلوك الأيون المشترك ولكن هناك حالتين هما الأكثر شيوعاً:
- محلول مكون من حامض ضعيف واحد أملاحه الذائبة مثلاً (حامض الخليك زائداً خلات الصوديوم).
- محلول مكون من قاعدة ضعيفة واحد أملاحها مثلاً (الأمونيا زائداً كلوريد الأمونيوم).
ومما يميز هذا المزيج هو قدرته أو قابليته على مقاومة التغير في تركيز أيون الهيدروجين عند إضافة كميات قليلة من حامض قوي أو قاعدة قوية، وهذه الخاصية تدعى السلوك البفري أو فعل بفر، ويمكن تعريف السلوك البفري (فعل بفر) بأنه قابلية المحلول على مقاومة التغير في تركيز أيون الهيدروجين عند إضافة كمية قليلة من حامض قوي أو قاعدة قوية، والمحلول الذي يمتلك السلوك البفري يسمى محلول بفر.
المحلول المنظم (محلول بفر): محلول مائي مكون من مزيج لحامض ضعيف مع أحد أملاحه (القاعدة القرينة للحامض الضعيف) أو قاعدة ضعيفة مع أحد أملاحها (الحامض القرين للقاعدة الضعيفة) ويكون لهذا المزيج القابلية على مقاومة التغير في الأس الهيدروجيني عند إضافة كمية قليلة من الحامض القوي أو القاعدة القوية إليه.
أولاً محلول يتكون من حامض ضعيف وأحد أملاحه الذائبة (القاعدة القرينة للحامض الضعيف):
إن إضافة أحد الأملاح المشتقة من حامض ضعيف إلى محلول نفس هذا الحامض الضعيف سينتج مزيج منهما وستنشأ حالة اتزان جديدة للحامض الضعيف تختلف عن حالة اتزان الحامض في محلوله لو كان لوحده ويمكن وصف حالة الاتزان الجديدة بوجود الملح المشتق من الحامض على ضوء المحلول المنظم الذي تم تحضيره من مزج حامض الخليك مع خلات الصوديوم.
بصورة عامة:
يفيد الأيون المشترك في التحكم في تخفيف حامضية أو قاعدية محلول أو الوصول إلى حالة الاعتدال للمحاليل.
ثانياً: محلول يتكون من قاعدة ضعيفة وأحد أملاحها الذائبة (الحامض القرين للقاعدة الضعيفة):
إن إضافة أحد الأملاح المشتقة من قاعدة ضعيفة إلى محلول نفس هذه القاعدة الضعيفة سينتج مزيج منهما وستنشأ حالة اتزان جديدة للقاعدة الضعيفة تختلف عن حالة اتزان القاعدة في محلولها لو كانت لوحدها، ويمكن وصف حالة الاتزان الجديدة بوجود الملح المشتق من القاعدة على ضوء المحلول المنظم الذي تم تحضيره من مزج محلول من الأمونيا مع كلوريد الأمونيوم.
ملاحظات:
- عند حل أي مسألة علينا أولاً تشخيص المحلول وعدد ونوع المواد التي يتضمنها المحلول.
- عندما يتضمن المحلول حامض ضعيف وملحه المشتق منه نستخدم العلاقة.
[acid ] يمثل تركيز الحامض الضعيف الابتدائي و[salt] يمثل تركيز الملح الابتدائي [+H] يمثل تركيز أيون الهيدروجين في محلول بفر (تركيز أيونات الحامض بوجود الملح) pH يمثل الدالة الحامضية لمحلول بفر.
3. إذا أعطى أو طلب مقدار التغير في الدالة الحامضية لمحلول الحامض الضعيف بعد إضافة الملح نستخدم العلاقة: ΔpH = (pH)2 – (pH)1
ΔpH: تمثل التغير في الدالة الحامضية لمحلول الحامض بعد إضافة الملح وتكون قيمتها موجبة دائماً.
2(pH) تمثل الدالة الحامضية للمحلول المنظم (بفر) و1(pH) الدالة الحامضية للحامض الضعيف.
4. عندما يكون: [salt] = [acid ] فإن pH = Pka او [+H] = Ka.
5. عندما يتضمن المحلول قاعدة ضعيفة وملحها نستخدم العلاقة:
[-OH]: يمثل تركيز أيون الهيدروكسيد في محلول بفر و pOH: تمثل الدالة الهيدروكسيدية لمحلول بفر.
6. إذا أعطى أو طلب مقدار التغير في الدالة القاعدية لمحلول القاعدة الضعيفة بعد إضافة الملح نستخدم العلاقة: ΔpH = (pH)2 – (pH)1
ΔpOH تمثل التغير في الدالة القاعدية لمحلول القاعدة الضعيفة بعد إضافة الملح وتكون قيمتها سالبة دائماً pOH)2) تمثل الدالة القاعدية للمحلول المنظم (بفر) وpOH)1) الدالة القاعدية للقاعدة الضعيفة.
7. لنفس المحلول فإن ΔpH = ΔpOH ولكن بعكس الإشارة.
احسب pH لمحلول يحتوي على الأمونيا بتركيز 0.15M وكلوريد الأمونيوم بتركيز 0.3M وقارن النتيجة مع قيمة pH محلول الأمونيا بتركيز 0.15M؟ (pKb=4.74 و log1.64 = 0.22).
حسابات لإيجاد pH محلول الأمونيا.
نلاحظ أن الدالة الحامضية للقاعدة قد انخفضت بوجود كلوريد الأمونيوم بسبب التأثير الحامضي للملح.
احسب تركيز أيون pH و +H لمحلول مكون من مزيج من 0.1M حامض الخليك و 0.2M من خلات الصوديوم؟ (Ka CH3COOH=1.8X10-5 و log 9= 0.96).
ما تركيز حامض الخليك في محلول يحوي إضافة إلى الحامض ملح خلات الصوديوم بتركيز 0.3M إذا علمت أن pH كانت تساوي 4.31؟ علماً أن (Ka CH3COOH=1.8X10-5 و log 0.37 = - 0.43).
ماذا يجب أن يكون تركيز كلوريد الأمونيوم في محلول يحتوي على الأمونيا P Kb=4.74 بتركيز 0.1M لتكون قيمة pH المحلول تساوي 9؟ (log 1.82 = 0.26).
محلول من الانلين بتركيز 1M ودالته الحامضية = 9.3 احسب عدد مولات كلوريد الانلينيوم اللازم إضافتها إلى نصف لتر من المحلول لخفض دالته الحامضية إلى 4.6؟ حيث (log 4 = 0.6).
احسب عدد مولات خلات البوتاسيوم اللازم إضافتها إلى ربع لتر من محلول لحامض الخليك بتركيز 0.05M لتتغير دالته الحامضية بمقدار 0.7 وحدة؟ Ka CH3COOH=2X10-5
أولاً حسابات لإيجاد pH الحامض الضعيف.
ثانياً: حسابات لإيجاد عدد مولات خلات البوتاسيوم:
تأثير إضافة الحوامض القوية والقواعد القوية إلى المحاليل المنظمة (محاليل بفر).
أولاً: تأثير إضافة حامض قوي إلى محلول منظم يتكون من حامض ضعيف وملحه عند إضافة كمية قليلة من حامض قوي إلى مزيج من حامض ضعيف وملحه فإن الإضافة لا تؤدي إلى زيادة ملحوظة في تركيز أيون الهيدروجين، (لا تنخفض قيمة الدالة الحامضية لمحلول يتكون من حامض ضعيف وملحه بعد إضافة حامض قوي)، وذلك لأن أيون الهيدروجين الناتج من تأين الحامض القوي لا يبقى طليقاً في المحلول بل يتفاعل مع الأيون السالب الناتج من تأين الملح فتتكون جزيئات من الحامض الضعيف غير المتفكك ولذلك لا تتأثر قيمة الدالة الحامضية للمحلول بشكل كبير.
علل: يلاحظ انخفاض طفيف ل pH محلول يتكون من حامض ضعيف وملحه بعد إضافة حامض قوي.
- لأن إضافة الحامض القوي تؤدي إلى زيادة تركيز الحامض الضعيف وهذه الزيادة في التركيز تؤدي إلى نقصان قليل في قيمة pH المحلول.
- علاقة محلول بفر الذي يتكون من حامض ضعيف وملحه بعد إضافة الحامض القوي.
[+H]: يمثل تركيز أيون الهيدروجين القادم من تأين الحامض القوي والذي يكافئ الزيادة أو النقص في تركيزي الملح و تركيز الإلكتروليت الضعيف.
ملاحظات:
1. عندما يعطي حجم الحامض القوي وتركيزه قبل إضافته لمحلول بفر نجد تركيزه بعد الإضافة حسب العلاقة التالية:
أو حسب العلاقة:
[الحامض القوي] بعد إضافته.
2. عندما يطلب حجم أو تركيز الحامض القوي قبل الإضافة نجد تركيز الحامض القوي باستخدام علاقة المحلول المنظم ثم بعدها نطبق قانون التخفيف.
احسب قيمة pH بعد إضافة 1ml من حامض الهيدروكلوريك تركيزه 10M إلى لتر من محلول بفر مكون من 0.1M وخلات الصوديوم بتركيز 0.1M علماً أن pKa CH3COOH =4.74.
ثانياً: تأثير إضافة قاعدة قوية إلى محلول منظم يتكون من حامض ضعيف وملحه عند إضافة كمية قليلة من قاعدة قوية إلى مزيج من حامض ضعيف وملحه فإن الإضافة تؤدي إلى زيادة في تركيز أيون الهيدروكسيد، أو بعبارة أخرى لا تنخفض قيمة الدالة الحامضية لمحلول يتكون من حامض ضعيف وملحه بعد إضافة قاعدة قوية وذلك لأن أيون الهيدروكسيد الناتج من تفكك القاعدة القوية لا يبقى طليقاً في المحلول بل يتفاعل مع الحامض الضعيف فيتحد مع أيون الهدروجين الناتج من تفكك الحامض الضعيف لتكوين الماء ولذلك لا تتاثر قيمة الدالة الحامضية للمحلول بشكل ملحوظ .
علل: يلاحظ ارتفاع طفيف في قيمة pH لمحلول يتكون من حامض ضعيف وملحه بعد إضافة قاعدة قوية؟
لأن إضافة القاعدة القوية تؤدي إلى زيادة تركيز الملح المشتق منه وهو ملح ذو تأثير قاعدي وإن زيادة تركيزه تزيد من قاعدية المحلول مما تؤدي إلى ارتفاع طفيف في قيمة pH المحلول.
علاقة محلول بفر الذي يتكون من حامض ضعيف وملحه بعد إضافة القاعدة القوية:
[-oH]: يمثل تركيز أيون الهيدروكسيد القادم من تأين القاعدة القوية والذي يكافئ الزيادة أو النقص في تركيز الملح و تركيز الإلكتروليت الضعيف.
ملاحظات:
1. عندما يعطي حجم القاعدة القوية وتركيزها قبل إضافته لمحلول بفر نجد تركيزه بعد الإضافة حسب العلاقة التالية:
أو حسب العالقة التالية:
[القاعدة القوية] بعد إضافته.
عندما يطلب حجم أو تركيز القاعدة القوية قبل الإضافة نجد تركيز القاعدة القوية باستخدام علاقة المحلول المنظم ثم بعدها نطبق قانون التخفيف.
احسب قيمة الأس الهيدروجيني pH
1. للتر من محلول بفر من الأمونيا بتركيز 0.1M وكلوريد الأمونيوم بتركيز 0.1M.
2. لنفس محلول بفر لكن بعد إضافة 1mL من محلول حامض الكبريتيك بتركيز 10M ثم احسب مقدار التغير الحاصل في قيمة pH وناقش النتيجة علماً أن Ka = 74.4.
1.
2.
نجد تركيز حامض الكبريتيك بعد الإضافة.
التغير ضئيل لأن المحلول منظم والقيمة سالبة لأن المادة المضافة هي حامض.
احسب قيمة الأس الهيدروجيني:
1. للتر من محلول بفر مكون من حامض الخليك بتركيز 0.1M وخلات الصوديوم بتركيز 0.1M.
2. لنفس محلول بفر لكن بعد إضافة 2mL من محلول هيدروكسيد الصوديوم تركيزه 5M ثم احسب مقدار التغير الحاصل في pH وناقش النتيجة (أهمل التغير الذي يحصل في حجم المحلول) علماً أن pkb=4.74
نلاحظ أن هناك زيادة طفيفة في الدالة الحامضية وسبب ذلك يعود إلى أن المحلول منظم.
تاثير إضافة حامض قوي إلى محلول يتكون من قاعدة ضعيفة وملحها.
عند إضافة كمية قليلة من حامض قوي مثل HCl فإن أيون +H الناتج من تفكك الحامض القوي لا يبقى طليقاً في المحلول بل سيتفاعل مع أيون -OH لتكوين الماء وبذلك يحافظ المحلول على أسه الهيدروجيني.
مثال:
علل: يلاحظ انخفاض طفيف لمحلول يتكون من قاعدة ضعيفة وملحها بعد إضافة حامض قوي؟
لأن إضافة الحامض القوي تؤدي إلى زيادة تركيز الملح المشتق منه وهو ملح ذو تأثير حامضي وزيادة تركيزه تزيد من حامضية المحلول مما يؤدي إلى انخفاض طفيف في قيمة pH المحلول.
محلول بفر المتكون من قاعدة ضعيفة وملحها بعد إضافة حامض قوي.
لتر من محلول منظم يحتوي على 5.0mol من الأمونيا و3.0mol من كلوريد الأمونيوم احسب قيمة pH المحلول بعد إضافة 0.1mol من حامض الكبريتيك pkb =4.74.
log 5=0.7
log3 = 0.5
رابعاً تأثير إضافة قاعدة قوية إلى محلول يتكون من قاعدة ضعيفة وملحها –OH
عند إضافة قاعدة قوية مثل KOH فإن تركيز أيون –OH الناتج من تفككها لا يبقى طليقاً بل يتفاعل مع الأيون الموجب الناتج من تفكك الملح لتكوين جزيئات من القاعدة الضعيفة وبذلك يحافظ المحلول على أسه الهيدروجيني مثال:
علل: يلاحظ ارتفاع طفيف في قيمة pH لمحلول يتكون من قاعدة ضعيفة وملحها بعد إضافة قاعدة قوية.
لأن إضافة القاعدة القوية تؤدي إلى زيادة تركيز القاعدة الضعيفة غير المتفكك وإن زيادة تركيزها تزيد من قاعدية المحلول مما تؤدي إلى ارتفاع طفيف في قيمة pH المحلول
علاقة محلول بفر الذي يتكون من قاعدة ضعيفة وملحها بعد إضافة القاعدة القوية:
محلول حجمه نصف لتر يحتوي على 0.1M من الأمونيا و0.2mol من ملح كلوريد الأمونيوم ما عدد مولات Ba(oH)2 الواجب إضافتها لكي تصبح pH المحلول تساوي 9.3 علماً أن kbNH3=2x10-5
محلول منظم يحتوي على 0.2M من كل من HCN وKCN احسب pH المحلول بعد إضافة 0.1m مول من حامض HCl إلى لتر منه Ka HCN=5X10-10 حيث أن log 5 = 0.7 , log3 = 0.5
لتر من محلول منظم يحتوي على 0.5mol من الأمونيا و0.3mol من كلوريد الأمونيوم احسب التغير في قيمة ph المحلول بعد إضافة 0.1mol من حامض الكبريتيك ثم ناقش النتيجة؟ حيث أن:
log3 =0.5 log 5 = 0.7
نلاحظ أن إضافة حامض الكبريتيك سبب انخفاضاً طفيفاً في pH المحلول لأن المحلول منظم (بفر).
لتر من محلول بفر يحتوي على مولات مختلفة من كل من حامض الخليك وخلات البوتاسيوم فيه [+H] يساوي 0.00001 وعندما أضيف إليه 0.05mol من حامض HCl تغير تركيز [+H] الى 0.00002 جد تراكيز مكونات المحلول؟ حيث أن: log 2 = 0.3 و p Ka CH3COOH = 4.7
نفرض تركيز الحامض = α والملح = β
2= = log2
حسابات بعد إضافة الحامض Hcl
حلول أسئلة الصف السادس الإعدادي
حل اسئلة رياضيات - علوم - عربي وجميع الكتب والمواد الأخرى



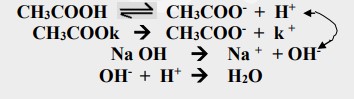
النقاشات