حلول الأسئلة
السؤال
قارن بين عنصر الصوديوم وأيون الصوديوم الموجب الشحنة من حيث عدد البروتونات والإلكترونات.
الحل
عنصر الصوديوم Na: العدد الذري=11= عدد الإلكترونات=عدد البروتونات.
أيون الصوديوم +Na:
- عدد الإلكترونات= 10.
- عدد البروتونات=11.
أي أن التغير لم يمس محتوى النواة لأن ذرة الصوديوم ظلت محتفظة بنفس عدد بروتوناتها وإنما حصل تغير في عدد الإلكترونات المحيطة بنواة ذرة عنصر الصوديوم لهذا تكون محصلة شحنة الأيون مساوية إلى (1+).
مشاركة الحل
الدرس الثاني: الأيون والجزيء
قارن بين عنصر الصوديوم وأيون الصوديوم الموجب الشحنة من حيث عدد البروتونات والإلكترونات.
عنصر الصوديوم Na: العدد الذري=11= عدد الإلكترونات=عدد البروتونات.
أيون الصوديوم +Na:
- عدد الإلكترونات= 10.
- عدد البروتونات=11.
أي أن التغير لم يمس محتوى النواة لأن ذرة الصوديوم ظلت محتفظة بنفس عدد بروتوناتها وإنما حصل تغير في عدد الإلكترونات المحيطة بنواة ذرة عنصر الصوديوم لهذا تكون محصلة شحنة الأيون مساوية إلى (1+).
قارن بين عنصر الصوديوم وأيون الصوديوم الموجب الشحنة من حيث عدد البروتونات والإلكترونات.
ذرة عنصر الفلور F9: العدد الذري=9= عدد الإلكترونات=عدد البروتونات.
أيون الفلور F-1:
- عدد الإلكترونات= 10.
- عدد البروتونات=9.
ويعني أن ذرة الفلور محتفظة بنفس عدد بروتوناتها وبالتالي فإن محصلة شحنة الذرة تكون مساوي إلى (1-).
اذكر أربع عناصر جزيئاتها ثنائية الذرة؟
- البروم Br2
- اليود I2
- کلور Cl2
- فلور F2
ما نظير العنصر؟
مصطلح كيميائي يعبر عن نوع من العناصر الكيميائية التي تتشابه في العدد الذري (عدد البروتونات) ولكنها تختلف في العدد الكتلي (لاختلافها في عدد النيترونات التي يحويها).
الفكرة الرئيسة:
1) ما الأيون، وما أنواعه؟ ثم اذكر بعض الأمثلة على أنواعه.
- الأيون الموجب: ذرة أو مجموعة ذرات مرتبطة غير متعادلة كهربائياً ذات شحنة موجبة تتكون نتيجة فقدانها إلكترون واحداً أو أكثر مثل أيون الصوديوم 1+Na.
- الأيون السالب: هو ذرة أو مجموعة ذرات مرتبطة غير متعادلة كهربائياً ذات شحنة سالبة تتكون نتيجة اكتساب الذرة إلكترون أو أكثر بسبب احتواء الغلاف الخارجي على أكثر من نصف عدد الإلكترونات مثل 1-F.
2) ما الجزيء؟ اذكر بعض الأمثلة على أنواعه.
الجزيء: هو أصغر وحدة في المادة توجد بحالة منفردة وتحتفظ بالخواص الكيميائية لها.
مثل جزيئة الأوكسجين O2 أو جزيئة الأوزون O3 أو جزيئة الماء H2O.
المفردات:
3) ما المقصود بنظير العنصر؟ واذكر نظاهر عنصر الهيدروجين.
نظير العنصر: مصطلح كيميائي يعبر عن نوع من العناصر الكيميائية التي تتشابه في العدد الذري (عدد البروتونات) ولكنها تختلف في العدد الكتلي (لاختلافها في عدد النيوترونات التي تحويها) مثال على ذلك: ، ، .
4) اذكر مثالاً لجزيء مركب، وعدد العناصر الداخلة فيه.
جزيء مركب هو جزيء الماء H2O، ذرتان هيدروجين وذرة أوكسجين.
5) ما هو المشترك بين رموز العناصر التالية: (نتروجين، نيون، صوديوم)؟ ثم اذكر عدد التأكسد لكل عنصر.
نتروجين N، نیون Ne، صوديوم Na، المشترك بين رموز العناصر حرف N.
6) لماذا تظهر شحنة موجبة على ذرة عنصر الصوديوم بعد فقدانها إلكتروناً واحداً؟ وضح ذلك بالرسم.
تظهر شحنة موجبة على ذرة عنصر الصوديوم بعد فقدان إلكترون واحد لأن عنصر الصوديوم يفقد إلكترون واحد من مداره الخارجي فيتحول إلى أيون الصوديوم الموجب الذي يكون غلافه الخارجي مشبع وأكثر استقراراً.
7) ما المقصود بالكتلة الذرية للعنصر؟
الكتلة الذرية للعنصر: تعني مجموع معدل الكتل الذرية للنظائر.
1) الجزيئات H2 و O2 ماذا يمثل الرقم 2 هنا؟ وضح ذلك بالرسم.
تمثل الرموز H2 و O2 أنها جزيئة ثنائية الذرة.
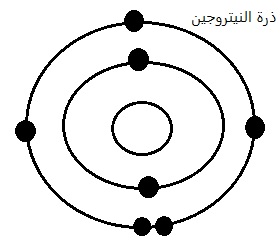
2) ارسم ذرة وأيون عنصر النتروجين، ماذا تتوقع؟ هل سيكون أيوناً موجباً ام سالباً؟ علماً أن عدده الذري=7 وعدده الكتلي=14.
نتروجين العدد الذري Z= 7.
المدار الأول 2 إلكترون.
المدار الثاني 5 إلكترون.
.jpg)
تكتسب ذرة النيتروجين ثلاث إلكترونات وذلك لأن غلافها الأخير يحتوي على أكثر من نصف عدد الإلكترونات.




